El cambio sigue a la evaluación de la FDA de informes que describen incidentes "raros pero graves" que ocurrieron cuando los usuarios de estos medicamentos experimentaron comportamientos complejos del sueño: sonambulismo, conducción del sueño "y participar en otras actividades sin estar completamente despierto", escribieron ayer representantes de la FDA (30 de abril ) en un anuncio de seguridad de drogas.
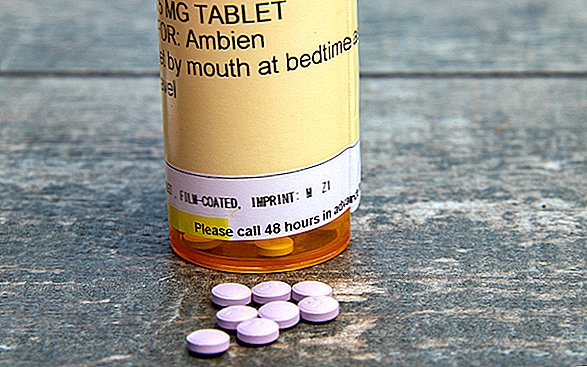
Ahora aparecerá una advertencia destacada en un recuadro en las guías de medicamentos del paciente y la información de prescripción de medicamentos para el insomnio como Ambien (nombre genérico zolpidem), Sonata (nombre genérico zaleplon), Lunesta (nombre genérico eszopiclona) y otros, según el anuncio.
También se incluirá otra de las advertencias más estrictas de la FDA, una contraindicación, que recomienda evitar un medicamento bajo ciertas condiciones, que aconseja a las personas que ya han experimentado comportamientos complejos de sueño mientras usan estos medicamentos que dejen de usar.
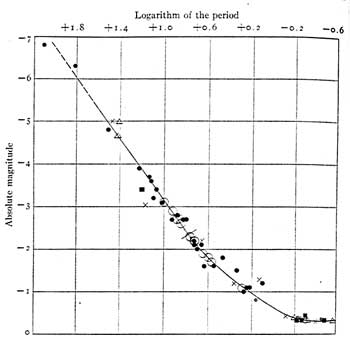
La FDA investigó datos que abarcan 26 años y encontró 66 ejemplos de comportamientos complejos del sueño asociados con estos medicamentos. Los pacientes realizaron acciones que provocaron hipotermia o pérdida de extremidades después de la exposición al frío extremo; Hubo casos de envenenamiento por monóxido de carbono, ahogamiento, intentos de suicidio aparentes, heridas de bala autoinfligidas y accidentes automovilísticos, con el paciente al volante.
En la mayoría de los casos, los pacientes ni siquiera recordaban los incidentes que provocaron sus lesiones, según la FDA.
Como estos hallazgos se basaron solo en informes de casos en la literatura médica y las cuentas que se enviaron directamente a la FDA, es posible que haya aún más ejemplos de lesiones por conductas de sueño complejas que no se han documentado, dijeron funcionarios de la FDA.
Millones de estadounidenses experimentan insomnio y dependen de medicamentos para ayudarlos a dormir, pero "es importante que los pacientes y los profesionales de la salud sean conscientes del riesgo", dijo el comisionado interino de la FDA, Dr. Ned Sharpless, en un comunicado.
"Estos incidentes pueden ocurrir después de la primera dosis de estos medicamentos para dormir o después de un período de tratamiento más prolongado, y pueden ocurrir en pacientes sin antecedentes de estos comportamientos e incluso con las dosis más bajas recomendadas", dijo Sharpless.
No se comprende bien cómo estos medicamentos desencadenan comportamientos complejos del sueño que pueden provocar lesiones, dijeron funcionarios de la FDA. La agencia continuará monitoreando los medicamentos para el insomnio y evaluando los riesgos que están relacionados con ellos, para determinar si se requerirán más acciones, dijo en el comunicado la Dra. Janet Woodcock, directora del Centro de Evaluación e Investigación de Medicamentos de la FDA.